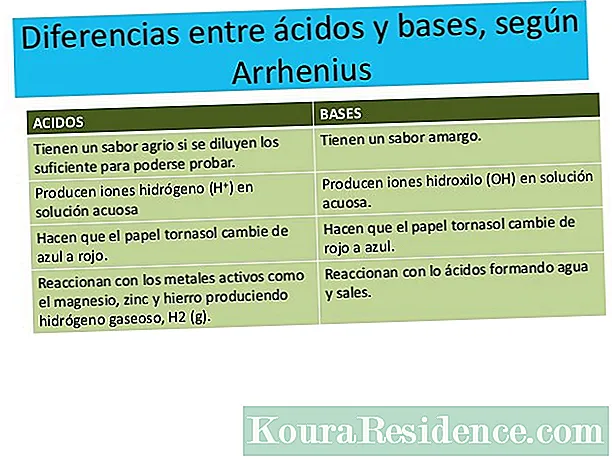
Både kemiska föreningar eftersom kemiska element består av molekyler, och dessa i sin tur består av atomer. Atomerna förblir enade tack vare bildandet av de så kallade kemiska länkar.
De kemiska bindningar är inte alla desamma: de beror i princip på de elektroniska egenskaperna hos de inblandade atomerna. Det finns två vanligaste typer av länkar: jonbindningar och den kovalenta bindningar.
Vanligtvis är kovalenta bindningar de som hålla ihop icke-metalliska atomer. Det händer att dessa elementers atomer har många elektroner i sitt yttersta skal och har en tendens att behålla eller få elektroner istället för att ge upp dem.
Det är därför det sätt på vilket dessa ämnen eller kemiska föreningaricos uppnår stabilitet är genom att dela ett par elektroner, uinte från varje atom. På detta sätt är det delade elektronparet gemensamt för de två atomerna och håller dem samtidigt ihop. I gaser adelsmän, till exempel, detta händer. Även i halogenelement.
När den kovalenta bindningen sker mellan element med liknande elektronegativitet, såsom mellan väte och kol, alstras en bindning apolär kovalent. Detta händer till exempel i kolväten.
På samma sätt bildas alltid homonukleära molekyler (som består av samma atom) apolära bindningar. Men om bindningen sker mellan element med olika elektronegativitet, produceras en högre elektrontäthet i en atom än i en annan, som ett resultat av detta bildas en pol.
En tredje möjlighet är att två atomer delar ett par elektroner, men att dessa delade elektroner bara är bidragna av en atom av dem. I så fall talar vi om dativ eller koordinat kovalent bindning.
För en dativlänk Du behöver ett element med ett fritt elektronpar (som kväve) och ett annat som är elektronbrist (som väte). Det är också nödvändigt att den med det elektroniska paret är tillräckligt elektronegativ för att inte förlora elektronerna att dela. Denna situation inträffar till exempel i ammonium (NH4+).
De ämnen innehållande kovalenta föreningar kan förekomma i vilket tillstånd som helst (fast, flytande eller gasformigt) och i allmänhet de är dåliga ledare för värme och elektricitet.
De visar ofta relativt låga smält- och kokpunkter Y är vanligtvis lösliga i polära lösningsmedel, som bensen eller koltetraklorid, men de har dålig löslighet i vatten. De är extremt stabila.
Många exempel på föreningar eller ämnen som innehåller kovalenta bindningar kan ges:
- Fluor
- Brom
- Jod
- Klor
- Syre
- Vatten
- Koldioxid
- Ammoniak
- Metan
- Propan
- Kiseldioxid
- Diamant
- Grafit
- Kvarts
- Glukos
- Paraffin
- Diesel
- Kväve
- Helium
- Freon