Innehåll
Specifik värme, känslig värme och latent värme är fysiska mängder:
De specifik värme av ett ämne är den mängd värme som måste tillföras en enhetsmassa av ämnet för att höja temperaturen med en enhet. Den mängden varierar mycket beroende på temperaturen ämnet befinner sig i innan värme appliceras på det. Det tar till exempel en kalori för att öka vattnet vid rumstemperatur med en grad, men det tar bara 0,5 kalori för att öka istemperaturen till -5 grader med en grad. Specifik värme beror också på atmosfärstrycket. Samma substans vid ett lägre atmosfärstryck har en lägre specifik värme. Exemplen nedan gäller för en temperatur på 25 grader och ett tryck på 1 atmosfär.
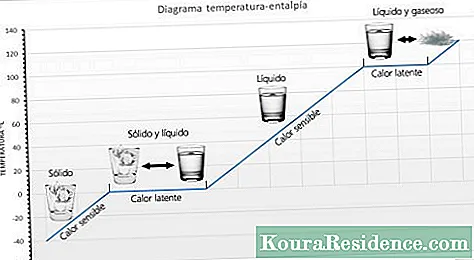
De kännbart värme Det är mängden värme som en kropp kan ta emot utan att påverka dess molekylära struktur. Om molekylstrukturen inte förändras ändras inte tillståndet (fast, flytande, gas). Eftersom molekylstrukturen inte förändras observeras en temperaturförändring, varför den kallas förnuftig värme.
De latent värme är den energi (värme) som krävs för att ett ämne ska ändra fas (tillstånd). Om förändringen är från fast till flytande kallas det fusionsvärme. Om förändringen är från flytande till gasform kallas det förångningsvärme. När värme appliceras på ett ämne som har nått temperaturen där det ändrar tillstånd är det omöjligt för temperaturen att öka, det ändrar helt enkelt tillstånd. Till exempel, om värme fortsätter att appliceras på kokande vatten, kommer det aldrig att överstiga 100 ° C. Beroende på ämnet kan latent värme vanligtvis mätas i kalorier per gram eller i kilojoules per kg (KJ).
Exempel på specifik värme
- Vatten (i flytande tillstånd): 1 kalori per gram för att öka 1 ° C
- Aluminium: 0,215 kalorier per gram
- Beryllium: 0,436 kalorier per gram
- Kadmium: 0,055 kalorier per gram
- Koppar. 0,0924 kalorier per gram
- Glycerin: 0,58 kalorier per gram
- Guld: 0,0308 kalori per gram
- Järn: 0,107 kalorier per gram
- Bly: 0,0305 kalorier per gram
- Kisel: 0,168 kalorier per gram
- Silver: 0,056 kalori per gram
- Kalium: 0,019 kalori per gram
- Toluen: 0,380 kalorier per gram
- Glas: 0,2 kalori per gram
- Marmor: 0,21 kalori per gram
- Trä: 0,41 kalori per gram
- Etylalkohol: 0,58 kalorier per gram
- Kvicksilver: 0,033 kalori per gram
- Olivolja: 0,47 kalorier per gram
- Sand: 0,2 kalori per gram
Exempel på förnuftig värme
- Applicera värme på vatten mellan 1 och 100 ° C
- Applicera värme på tenn som är lägre än 240 ° C
- Applicera blyvärme som är under 340 ° C
- Applicera värme på zink som är under 420 ° C
- Applicera värme på aluminium som är lägre än 620 ° C
- Applicera värme på brons som är mindre än 880 ° C
- Applicera värme på nickel under 1450 ° C
Exempel på latent värme
Vatten: latent smältvärme: 80 kalorier per gram (det tar 80 kalorier för ett gram is vid 0 ° C för att bli vatten), latent förångningsvärme: 540 kalorier per gram (det tar 540 kalorier för ett gram vatten vid 100 ° C för att bli ånga).
Stål: latent fusionsvärme: 50 kalorier
Alumino: latent fusionsvärme: 85 kalorier / 322-394 KJ; latent förångningsvärme: 2300 KJ.
Svavel: latent fusionsvärme: 38 KJ; latent förångningsvärme: 326 KJ.
Kobolt: latent fusionsvärme: 243 KJ
Koppar: latent fusionsvärme: 43 kalorier; latent förångningsvärme: 2360 KJ.
Tenn: latent fusionsvärme: 14 kalorier / 113 KJ
Fenol: latent fusionsvärme: 109 KJ
Järn: latent fusionsvärme: 293 KJ; latent förångningsvärme: 2360 KJ.
Magnesium: latent fusionsvärme: 72 kalorier
Kvicksilver: latent fusionsvärme: 11,73 KJ; latent förångningsvärme: 356,7 KJ.
Nickel: latent fusionsvärme: 58 kalorier
Silver: latent fusionsvärme: 109 KJ
Bly: latent fusionsvärme: 6 kalorier; latent förångningsvärme: 870 KJ.
Syre: latent fusionsvärme: 3,3 kalorier
Guld: latent fusionsvärme: 67 KJ
Zink: latent fusionsvärme: 28 kalorier


